Chronisch-entzündliche Darmerkrankungen
Chronisch-entzündliche Darmerkrankungen (CED) nehmen weltweit zu. Nach Angaben der European Crohn’s and Colitis Organisation (ECCO) stieg die Inzidenz des Morbus Crohn (MC) über die vergangenen 30 Jahre jährlich um 4 bis 15 %. [1] Auch die Inzidenz der Colitis ulcerosa (CU) nimmt zu; allein in Europa und den USA ist rund eine Million Menschen davon betroffen. [2]
Diagnose
Die Symptome dieser Krankheiten sind vielfältig, oft unspezifisch und können die Lebensqualität der Betroffenen erheblich beeinträchtigen.
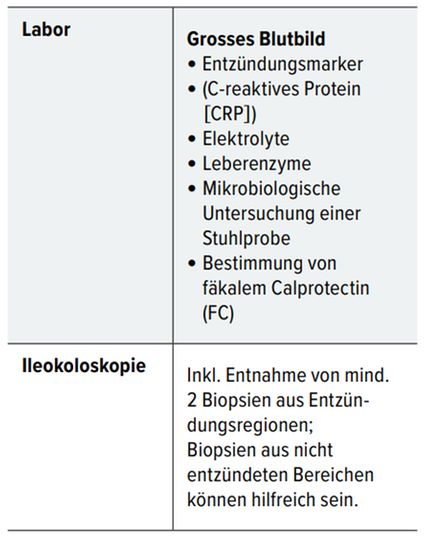
Die Diagnose von MC und CU basiert auf einer Kombination klinischer, endoskopischer, histologischer und Laboruntersuchungen einschliesslich Stuhlproben (Tab. 1). Beim Verdacht auf MC kann es zudem nötig sein, für die Untersuchung des Dünndarms bildgebende Verfahren einzusetzen. Ausserdem müssen infektiöse Ursachen inklusive Clostridium difficile (C. difficile) und Parasitenbefall ausgeschlossen werden. [3•] Im Rahmen der Laboruntersuchungen sollte auch auf Eisenmangel untersucht werden, da Anämie eine der häufigsten Komplikationen bei CED ist. Dazu werden neben MCV und Hämoglobin Serumferritin und Transferrinsättigung bestimmt.
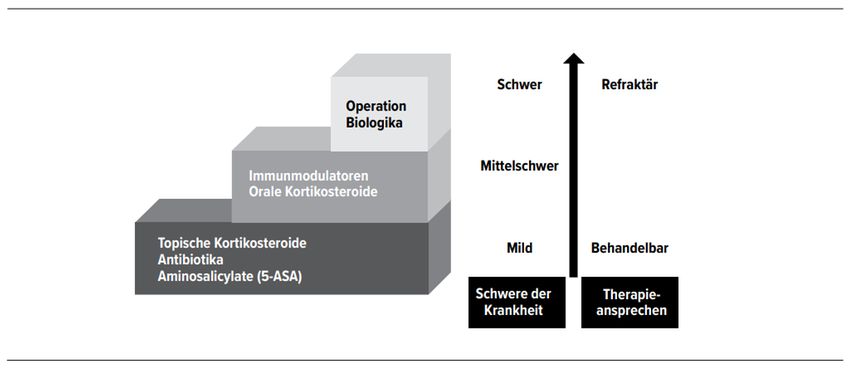
Abb. 1: Therapieeskalation bei CED [4]
Dabei sprechen bei Patienten mit aktiver Entzündung Serumferritinwerte > 100 μg/l und eine Transferrinsättigung < 20 % für eine Anämie bei chronischer Entzündung («anemia of chronic disease», ACD). Bei Serumferritinwerten zwischen 30 und 100 μg/l ist eine Kombination aus ACD und Eisenmangelanämie wahrscheinlich. [3•]
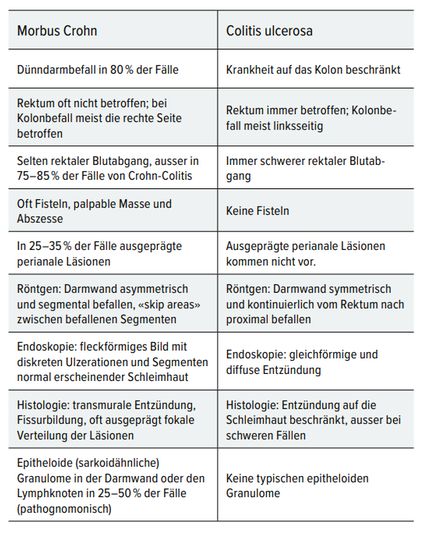
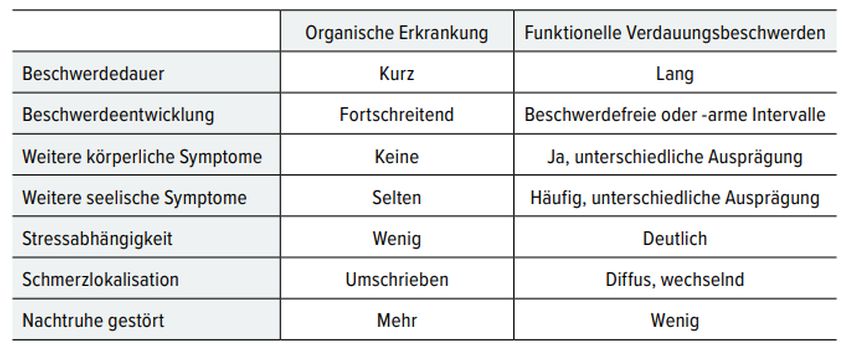
Tab. 2: Unterschiede zwischen M. Crohn und Colitis ulcerosa
Sinnvoll ist die Bestimmung von Entzündungsmarkern wie C-reaktivem Protein (CRP). Erhöhte Werte korrelieren vor allem bei MC mit der klinischen Schwere der Krankheit, bei der CU ist dies weniger der Fall, ausser bei einer schweren akuten Kolitis. Der empfindlichste Entzündungsmarker im Darm ist das fäkale Calprotectin (FC).
Die FC-Bestimmung dient der initialen Diagnose und dem Monitoring von CED. Es ist jedoch nicht spezifisch für MC und CU, sondern kann auch bei anderen entzündlichen Prozessen im Darm oder bei Neoplasien erhöht sein. Tabelle 2 zeigt die Unterschiede beider Krankheiten auf. [3•]
Therapieoptionen und Monitoring bei CED
Die Therapie von MC und CU hängt ab von der Krankheitslokalisation, -aktivität, -schwere und krankheitsbedingten Komplikationen (Abb. 1). Auch individuelle Risikofaktoren des Patienten und die Kosten der Therapie dürfen dabei nicht ausser Acht gelassen werden. Da die klinischen Symptome nicht immer mit der zugrunde liegenden Entzündungsreaktion korrelieren, ist es essenziell, den Krankheitsverlauf und das Ansprechen auf die Therapie in regelmässigen Intervallen mittels Endoskopie, Bildgebung und Bestimmung von CRP und FC zu überprüfen, um zudem dem Entstehen kolorektaler Karzinome vorzubeugen (Tab. 3). [3•, 4, 5–7••]
Ziele der Behandlung sind die Induktion und das Aufrechterhalten einer Remission bzw. das Lindern akuter Schübe. Wichtig ist, bereits früh eine medikamentöse Therapie einzuleiten, selbst bei asymptomatischen Patienten, da dies den Krankheitsverlauf langfristig positiv beeinflusst. [4, 7••]
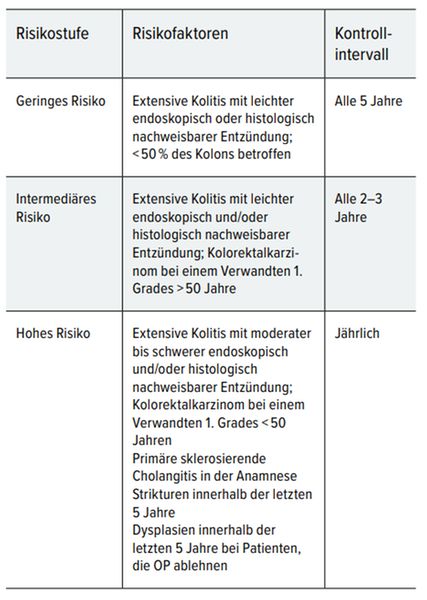
Tab. 3: Empfohlene Untersuchungen und Intervalle für das Monitoring der Colitis ulcerosa [2]
Milde bis mittelschwere CED
In ihren aktuellen MC-Leitlinien empfehlen die ECCO und das American College of Gastroenterology (ACG) bei milder bis moderater Krankheitsausprägung und Beschränkung auf das Ileum und/oder das Colon ascendens für die Erstlinientherapie Budesonid, das stark topisch wirkt und weniger systemische Nebenwirkungen verursacht. [4, 7••]
Bei CU-Patienten, die lediglich an einer Proktitis leiden, empfehlen die Leitlinien Mesalazin-Zäpfchen, bei wiederkehrenden Symptomen auch systemische Steroide, Immunsuppressiva oder Biologika. [8••] Bei ausgedehnter milder bis moderater CU sollte die initiale Therapie mit Aminosalicylat- Einläufen in Kombination mit oraler Gabe von Mesalazin eingeleitet werden. [8••]
Mittelschwere bis schwere CED
Für Patienten mit aktiver moderater bis schwerer MC empfiehlt die ECCO systemische Steroide, um eine Remission zu induzieren. [7••] Für Patienten mit einer Kontraindikation für Steroide kann Methotrexat in Erwägung gezogen werden. [7••]
Eine starke Empfehlung sprechen die Leitlinien für TNF-α-Inhibitoren aus. [4, 7••] Von einem frühen Einsatz der Biologika profitieren vor allem Patienten mit einer ungünstigen Prognose, zum Beispiel infolge Fistelbildung, ausgedehnter Entzündung oder tiefer Ulzera, da damit Operationen und Hospitalisationen hinausgezögert werden können. [7••] Vor Beginn einer Therapie mit TNF-α-Inhibitoren sollte auf Tuberkulose, Hepatitis B und andere latente oder aktive Infektionen untersucht und diese behandelt werden. [4] Grundsätzlich sollte der Impfstatus des Patienten überprüft und notwendige Impfungen vorgenommen werden. [4, 7••]
Bei einer mittelschweren bis schweren CU raten die Leitlinien zu systemischen Kortikosteroiden oder TNF-α-Inhibitoren. [2•, 8••] Patienten mit schwerer CU müssen stationär behandelt werden. Standardtherapie sind Kortikosteroide i.v., wobei man möglichst schon ab dem dritten Tag der Steroidtherapie mögliche Alternativen erwägen sollte, falls der Patient auf die Behandlung nicht anspricht. Optionen sind beispielsweise Biologika, Tacrolimus oder Ciclosporin. Ausserdem ist auf adäquaten Ersatz von Flüssigkeit und Elektrolyten, Thromboseprophylaxe und Behandlung der Anämie zu achten. Tritt nach maximal einer Woche keine Besserung ein, sollte über einen chirurgischen Eingriff nachgedacht werden. [8••]
Überlegen Sie:
Bei welchen Beschwerden würden Sie den Verdacht auf Colitis ulcerosa haben und weitere Untersuchungen einleiten?
Symptome der CU sind blutige Diarrhö, Schleim auf dem Stuhl, Tenesmen, Stuhldrang und Bauchkrämpfe, für die keine anderen Ursachen gefunden werden
Biosimilars bei CED
Der Einsatz der Biologika wird nicht selten durch die hohen Therapiekosten dieser Präparate limitiert. Biosimilars können helfen, die Kosten zu reduzieren. [4] Dies erleichtert auch einen frühen Einsatz von TNF-α-Inhibitoren und damit eine aggressivere Therapie. [5]
Derzeit sind in der Schweiz für CED Biosimilars von Adalimumab (ABP501, FKB327, GP2017, MSB11022, SB5) und Infliximab (CTP13) verfügbar. [5]
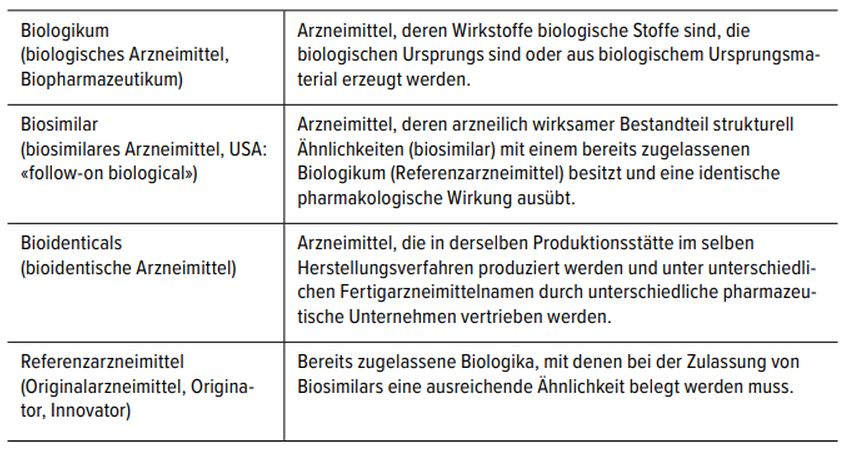
Biosimilars sind biologische Arzneimittel, deren wirksame Bestandteile biotechnologisch und mit gentechnisch veränderten Organismen hergestellt werden. Die Wirkstoffe sind einem bereits zugelassenen Referenzarzneimittel strukturell sehr ähnlich und haben eine identische pharmakologische Wirkung. [9, 10] Aufgrund des Herstellungsprozesses weisen Biosimilars bei gleicher Aminosäuresequenz eine minimale Variabilität (Mikroheterogenität) auf, die sie von den Referenzarzneimitteln unterscheidet. [9, 10] Für die Wirksamkeit und Sicherheit ist dies unkritisch, solange die Veränderungen das im Zulassungsprozess definierte Ausmass nicht überschreiten. Um dies zu beurteilen, werden analytische Verfahren mit hoher Sensitivität eingesetzt, um strukturelle und funktionelle Abweichungen zu entdecken. Von Biosimilars zu unterscheiden sind Bioidenticals (Tab 4). [9, 10] Biosimilars sind auch keine Generika (Tab. 5). [11]
Strenge Zulassungskriterien
Die Zulassung von Biosimilars unterliegt strengen Regeln und ist aufwendiger als die Zulassung von Generika (Abb. 2). [12] Gemäss den aktuellen Vorgaben von Swissmedic muss der Antragsteller nachweisen, dass das Biosimilar dem Originalpräparat in Bezug auf Struktur, biologische Aktivität, Wirksamkeit, Sicherheit und Immunogenität ähnlich genug ist, um relevante klinische Unterschiede mit genügender Zuverlässigkeit ausschliessen zu können. [9, 13] Es muss also nicht nur nachgewiesen werden, dass die biochemische Zusammensetzung und Struktur des Biosimilars dem Originalpräparat entsprechen, sondern das Biosimilar muss auch in vitro mit dem Original hinsichtlich seiner biologischen Eigenschaften und Wirkungsmechanismen verglichen werden. [9, 10] Im Falle der TNF-α-Inhibitoren bedeutet dies, dass sie TNF-α neutralisieren, Apoptose induzieren, Komplement binden und zellvermittelte Zytotoxizität demonstrieren müssen. Und nicht zuletzt müssen die Hersteller anhand von klinischen Daten auch zeigen, dass das Biosimilar pharmakokinetisch und -dynamisch äquivalent zum Originator ist und eine äquivalente klinische Wirksamkeit aufweist. [12, 14]
Wird ein Biosimilar zugelassen, wird es unter Anwendung des Verfahrens der Extrapolation in der Regel für alle Indikationen zugelassen, für welche das Referenzarzneimittel autorisiert wurde. [11] Dies deshalb, weil sich das Biosimilar diesbezüglich auf die Wirksamkeitsstudien des Originators abstützen kann. Die für die Zulassung des Biosimilars geforderten klinischen Studien dienen nicht dem Nachweis der therapeutischen Wirksamkeit des biosimilaren Wirkstoffs, sondern dem Nachweis, dass das biosimilare Produkt keine klinisch relevanten Unterschiede zum Referenzarzneimittel aufweist, welche die Wirksamkeit und Sicherheit beeinflussen könnten. [11] Im Bereich der Gastroenterologie bedeutet dies, dass die Biosimilars von Infliximab und Adalimumab, für die es Zulassungsstudien bei rheumatoider Arthritis und Plaque-Psoriasis gibt, auch bei CED-Patienten eingesetzt werden können.
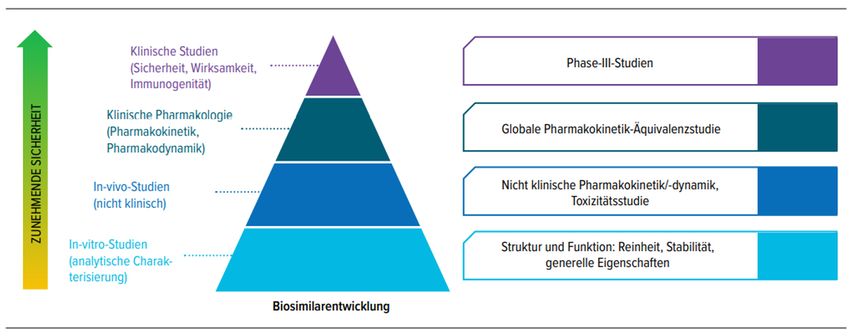
Abb. 2: Entwicklungsstufen von Biosimilars [12]
Behandlung mit Biosimilars
In der Klinik werden Biosimilars sowohl für die initiale Therapie mit diesem biologischen Wirkstoff bei einem therapienaiven Patienten eingesetzt als auch bei der Umstellung eines bereits mit dem Referenzarzneimittel behandelten Patienten auf das Biosimilar. [10] Vor allem die Umstellung von Patienten mit oft bereits jahrelanger Biologikatherapie verursacht immer wieder Verunsicherung bezüglich der Austauschbarkeit des Referenzarzneimittels mit einem Biosimilar oder von Biosimilars untereinander. [10] Bislang wurde jedoch in keiner klinischen Studie, die den Switch einer laufenden biologischen Therapie auf ein Biosimilar untersucht hat, ein (signifikanter) Unterschied hinsichtlich der Wirksamkeit oder Verträglichkeit zwischen Biosimilar und Referenzarzneimittel festgestellt. [9, 10, 15]
Vorgehen bei der Umstellung auf ein Biosimilar
Die Zulassung von Biosimilars basiert auf klinischen Daten, die mit derselben Dosis und Applikationsart wie beim Referenzmedikament erhoben wurden. Daher gelten nach der Umstellung auf ein Biosimilar ebenfalls Dosis, Behandlungsintervall und Applikationsweg wie beim Referenzpräparat. [9]
Einsatz von Biosimilars bei CED
2013 wurden die ersten Biosimilars durch die Europäische Arzneimittelagentur (EMA) zugelassen, zunächst für die Rheumatherapie. [14] Seit der Markteinführung 2015 werden auch zunehmend Daten zur Biosimilar-Therapie bei CEDPatienten generiert. So zeigte die grosse randomisierte und kontrollierte Studie (RCT) NOR-SWITCH bei Patienten mit immunvermittelten Krankheiten, unter anderem MC und CU, hinsichtlich des klinischen Ansprechens, des Aufrechterhaltens der Remission oder der Nebenwirkungen keine Unterschiede zwischen der Originalsubstanz (Infliximab) und dem Biosimilar (CT-P13).
[16] Zum gleichen Ergebnis kommt eine Beobachtungsstudie mit 87 MC-Patienten aus Italien mit Adalimumab und dem Biosimilar ABP501. 25 der eingeschlossenen Patienten hatten noch kein Biologikum erhalten, die übrigen wurden von der Originalsubstanz auf das Biosimilar umgestellt. Nach drei Monaten erreichten die nicht mit einem Biologikum vorbehandelten Patienten eine Ansprechrate von 60 % und eine Rate an klinischen Remissionen von 56 %. Von den zuvor mit der Originalsubstanz behandelten Patienten waren nach sechs Monaten noch immer 95,2 % in Therapie, ohne einen signifikanten Anstieg der Krankheitsaktivität zu zeigen. [17]
Überlegen Sie:
Setzen Sie bei Ihren Patienten bereits Biosimilars ein? Wenn nicht, warum ist das so?
Nocebo-Effekte vermeiden
Der Nocebo-Effekt bezeichnet die negative Wirkung einer Therapie, die ausgelöst wird durch negative Erwartungen des Patienten. Der Nocebo-Effekt kann auch bei der Umstellung auf Biosimilars eine Rolle spielen und zu mangelnder Therapieadhärenz sowie unnötigen Behandlungsabbrüchen führen. [18, 19]
Der Arzt und das den Patienten betreuende Team haben entscheidenden Einfluss darauf, den Nocebo-Effekt zu vermeiden. Die Umstellung auf ein Biosimilar sollte immer ausführlich mit dem Patienten besprochen werden, damit er eine informierte Entscheidung darüber treffen kann. Er sollte darüber hinaus ermutigt werden, sich bei jedem neuen oder untypischen Symptom an den Arzt zu wenden. Dies kann die Akzeptanz des Biosimilars durch den Patienten erheblich verbessern. [18, 19]
Ökonomische Aspekte
Ein wichtiger Aspekt bei der Behandlung mit Biologika sind die Kosten. Wie dem Helsana-Arzneimittelreport für die Schweiz zu entnehmen ist, betrugen die hochgerechneten Kosten für Immunsuppressiva (inkl. Biologika) für das Jahr 2018 1,12 Milliarden Franken, was 14,7 % der Gesamtkosten für Arzneimittel entsprach. Im Vergleich dazu betrug der Anteil der Onkologika an den Totalkosten 9,6 %. [20] In der Liste der Wirkstoffe, die die höchsten Kosten verursacht haben, liegen Adalimumab und Infliximab auf den Rängen 1 und 2.
Hier bieten die Biosimilars ein grosses Potenzial zur Kosteneinsparung, da der Preis eines Biosimilars bei der Neuaufnahme auf die Spezialitätenliste (SL) gemäss Vorgaben des BAG mindestens 25 % unter demjenigen des Referenzprodukts liegen muss. [21] Für Adalimumab und Infliximab ergibt sich daraus ein Sparpotenzial von ungefähr 68 Mio. Franken pro Jahr, wenn alle Patienten vom Originalprodukt auf ein Biosimilar umgestellt würden.
Laurent Peyrin-Biroulet, Silvio Danese (Präsident und Past-Präsident der europäischen Crohn- und Colitis-Gesellschaft [ECCO]) und Kollegen sehen in den Biosimilars aufgrund des niedrigeren Preises das Potenzial, mehr IBD-Patienten mit einem biologischen Arzneimittel zu behandeln und früher mit dieser Therapie zu starten. [22] Sie plädieren dafür, die Behandlung bei Biologika-naiven Patienten direkt mit einem Biosimilar zu beginnen und Patienten, die bereits mit einem Biologikum behandelt werden, auf ein Biosimilar umzustellen. [22] Dabei ist eine ausführliche Information und Edukation der Patienten unerlässlich, um Nocebo-Effekte zu verhindern und die Langzeitadhärenz zu verbessern.
Funktionelle Verdauungsstörungen
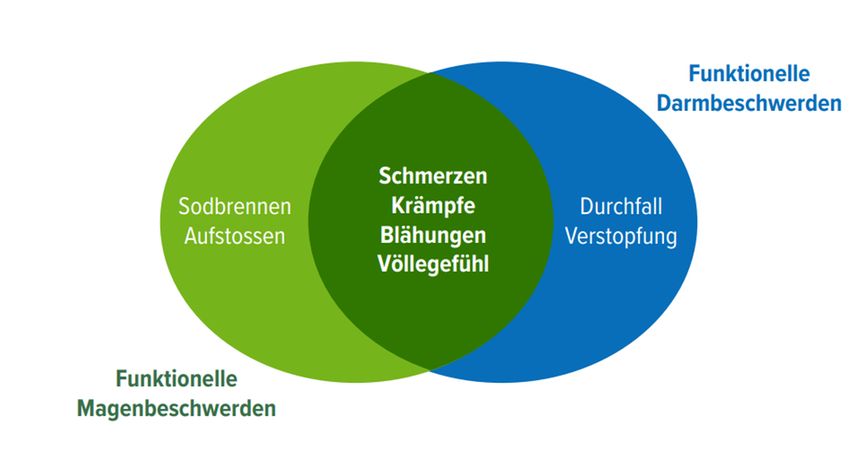
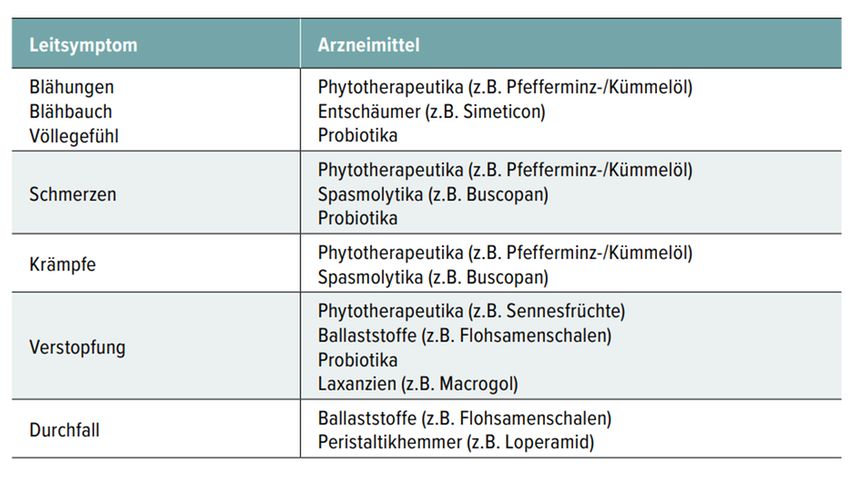
Funktionelle Störungen des Verdauungstraktes wie Dyspepsie und das Reizdarmsyndrom (RDS) gehören zu den häufigsten Krankheiten in der gastroenterologischen Praxis [23] und sind chronische (Dauer mindestens drei Monate) oder rezidivierende, multifaktorielle Krankheiten, für die keine organische Ursache gefunden werden kann (Tab. 6). Die häufigsten Symptome sind Oberbauchschmerzen/Sodbrennen, Völlegefühl, Blähungen, Bauchschmerzen/- krämpfe, Verstopfung oder Durchfall (Abb. 3). [24, 25]
Diagnose und Einteilung
Die Diagnose einer funktionellen Verdauungsstörung ist vor allem eine Ausschlussdiagnose. Daher ist eine sorgfältige und umfassende Anamnese, die auch die Ernährungsgewohnheiten und psychische Faktoren einschliesst, die Basis für das weitere Vorgehen. Die Basisdiagnostik umfasst zudem:
Körperliche (inkl. rektale) Untersuchung
Basislabor (inkl. Zöliakie-Antikörper und Stuhluntersuchungen auf intestinale Entzündungsmarker wie Calprotectin sowie Erreger, z. B. Lamblien)
Abdomenultraschall
Gynäkologische Untersuchung bei Frauen [24, 25]
Zusätzlich werden empfohlen:
Ileokoloskopie (bei Diarrhö Stufenbiopsien obligat)
Magenspiegelung (mit Duodenalbiopsien)
Bei Verdacht individuell bildgebende Verfahren [24, 25]
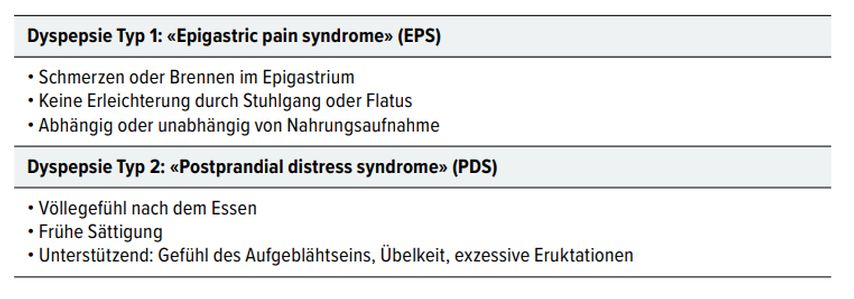
Die Dyspepsie ist nach den Rom-IVKonsensus- Kriterien unterteilt in Typ 1 (epigastrisches Schmerzsyndrom, EPS) und Typ 2 (postprandiales Disstress-Syndrom, PDS) (Tab. 7). Beim Typ 1 kommt es abhängig oder unabhängig von einer Mahlzeit zu Schmerzen oder Brennen im Epigastrium. Stuhlgang oder Flatus bringen keine Erleichterung. Typ 2 tritt während und nach dem Essen auf und geht mit früher Sättigung, Völlegefühl, Blähungen, häufigem Aufstossen und Übelkeit einher. Beide Typen können auch gleichzeitig auftreten. [24]
Der Reizdarm ist nach den Rom-IV-Kriterien gekennzeichnet durch wiederkehrende abdominelle Schmerzen, durchschnittlich mindestens einmal pro Woche, und Diarrhö oder Verstopfung. [25] Gemäss der S3-Leitlinie der Deutschen Gesellschaft für Verdauungs- und Stoffwechselkrankheiten (DGVS) und der Deutschen Gesellschaft für Neurogastroenterologie und Motilität (DGNM) müssen die folgenden drei Kriterien erfüllt sein, um von einem Reizdarmsyndrom sprechen zu können: [26]
Chronische Beschwerden (> 3 Monate), die von Patient und Arzt auf den Darm bezogen werden und in der Regel mit Veränderungen des Stuhlgangs einhergehen.
Der Patient sucht wegen der Beschwerden Hilfe und wird durch die Beschwerden in seiner Lebensqualität relevant beeinträchtigt.
Es liegt keine andere Krankheit als Ursache der Beschwerden vor.
Ursachen und pathophysiologische Überlegungen
Häufig sind Magen-Darm-Infektionen Auslöser anhaltender gastrointestinaler Beschwerden. Beispiele dafür sind das postinfektiöse Reizdarmsyndrom oder mit Helicobacter pylori assoziierte dyspeptische Beschwerden. Aber auch akute und chronische Belastungen wie z. B. Stress, Ernährungsumstellung, psychosomatische Begleiterkrankungen können die Verdauungsfunktion nachhaltig beeinflussen. In den letzten Jahren sind deshalb das biopsychosoziale Modell und die Hirn-Darm- Achse immer mehr in den Fokus gerückt. Ausdrücke wie «Das liegt mir auf dem Magen », «Das ist schwer zu schlucken», «Schmetterlinge im Bauch haben» zeugen davon, dass wir schon lange wissen, dass Emotionen und Stress einen Einfluss auf das Magen-Darm-System haben.
Tab. 7: Funktionelle Dyspepsie – Definition (Rom-IV-Kriterien). EPS und PDS können zeitgleich auftreten
Das biopsychosoziale Modell
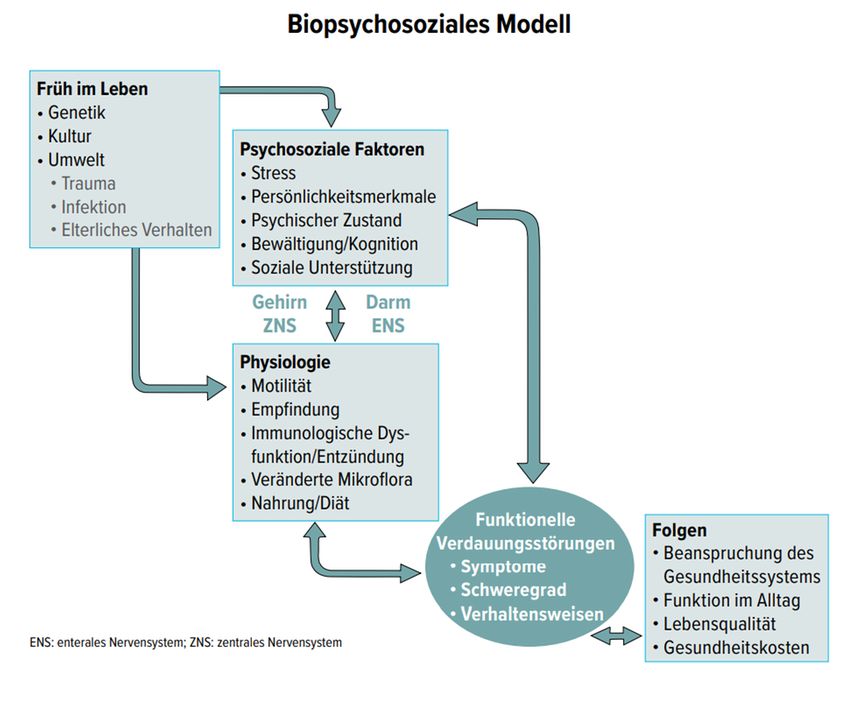
Heute geht man davon aus, dass genetische und soziokulturelle Einflüsse sowie Umweltfaktoren die psychosoziale Entwicklung und damit Persönlichkeitsmerkmale, Stressanfälligkeit, psychologische Aspekte, kognitive Fähigkeiten und Bewältungsstrategien beeinflussen. Diese Faktoren beeinflussen auch die Anfälligkeit für Störungen der Darmfunktion: abnorme Motilität oder Empfindlichkeit, eine veränderte Immunfunktion oder Entzündung der Schleimhaut, das mikrobielle Milieu sowie die Wirkung von Nahrungsmitteln und Nährstoffen. Darüber hinaus beeinflussen diese Hirn-Darm-Variablen wechselseitig die ZNS-Expression (Abb. 4). [27] Funktionelle gastrointestinale Störungen sind demnach ein Produkt dieser Interaktionen zwischen psychosozialen Faktoren und veränderter Darmphysiologie via die Hirn-Darm-Achse. [27] Es ist deshalb wichtig, in der Betreuung von Patienten mit funktionellen Verdauungsstörungen auch den psychosozialen Faktoren Beachtung zu schenken.
Abb. 4: Konzeptuelle Darstellung der biopsychosozialen Pathogenese, der klinischen Erfahrung und der Auswirkungen von funktionellen gastrointestinalen Störungen (adaptiert nach: Drossmann DA) [27]
Therapie funktioneller Verdauungsstörungen
Die Behandlung von funktionellen Verdauungsstörungen ist eine rein symptomatische. Die primären Ziele sind die Linderung der Blähungen, Krämpfe und Schmerzen sowie die Stuhlregulierung und die Verbesserung der Lebensqualität. Vor allem bei Reizdarmsyndrom sind ernährungsmedizinische Massnahmen sinnvoll. Herrschen Schmerzen, Blähungen und Diarrhö vor, ist eine FODMAP-Diät empfehlenswert. FODMAP steht für fermentierbare Oligo-, Di- und Monosaccharide und Polyole. Dabei handelt es sich um kurzkettige Kohlenhydrate, die im Dünndarm schlecht absorbiert werden. Sie werden spätestens im Dickdarm osmotisch aktiv und dort rasch fermentiert. Die Folgen sind Bauchschmerzen, Blähungen und ein weicher, voluminöser Stuhl. Eine FODMAP- arme Ernährung eliminiert zahleiche Nahrungsmittel und sollte daher in Zusammenarbeit mit einer medizinischen Ernährungsberatung erfolgen, um zu starke Einschränkungen und eine Mangelernährung zu vermeiden. [26]
Sinnvolle Begleitmassnahmen sind Sport bzw. körperliche Aktivität und Entspannungstechniken, da funktionelle Verdauungsbeschwerden häufig im Zusammenhang mit Stress oder Emotionen stehen. In manchen Fällen kann auch eine psychologische/psychosomatische Intervention hilfreich sein. [26]
Medikamentöse Behandlung
Die medikamentöse Therapie sollte symptomorientiert erfolgen (Tab. 8). Hier haben sich mehrere phytotherapeutische Präparate als wirksam erwiesen und sie sollten individuell ins Behandlungskonzept aufgenommen werden. Geeignete Medikamente sind zum Beispiel die Kombination aus ätherischem Pfefferminz- und Kümmelöl. [24] Pfefferminzöl wirkt durch die Bindung von Menthol an den TRPM8-Rezeptor schmerzlindernd und spasmolytisch, indem es den Kalziumeinstrom in die Muskelzelle hemmt. [28] Kümmelöl wird vor allem bei Blähungen und Völlegefühl eingesetzt, da es entblähend wirkt. Es senkt die Oberflächenspannung von Schäumen im Nahrungsbrei, reduziert die Gasbildung im Darm und hemmt selektiv pathogene Mikroorganismen des Darms, ohne die nützlichen Darmmikroorganismen zu beeinträchtigen. [29, 30] Die Kombination aus Pfefferminz- und Kümmelöl erwies sich in einer Studie als ebenso gut wirksam wie das Prokinetikum Cisaprid. [31]
Bei Dyspepsie können darüber hinaus evidenzbasiert Protonenpumpenblocker, eine Helicobacter-pylori-Eradikationstherapie oder Antidepressiva eingesetzt werden. [24]
Zusammenfassung der in diesem med·Diplom vermittelten Lerninhalte
• Gastrointestinale Störungen gehören zu den häufigsten Beschwerden in der Praxis und können die Lebensqualität der Betroffenen erheblich beeinträchtigen.
• Da die Symptome oft unspezifisch sind, sind eine sorgfältige Anamnese und Diagnostik nötig, um funktionelle Beschwerden wie Dyspepsie und Reizdarm von chronisch-entzündlichen Darmerkrankungen (CED) zu unterscheiden.
• Während die funktionellen Störungen meist symptomatisch gut zu behandeln sind (unter anderem mit Phytotherapeutika), ist bei den CED oft eine stufenweise Therapieeskalation erforderlich, wobei Biologika und Biosimilars eine zunehmend grössere Rolle spielen.
Klinische Relevanz
Funktionelle Verdauungsbeschwerden können unbehandelt die Lebensqualität einschränken und weitere körperliche sowie psychische Störungen verursachen. Unbehandelte CED können unter anderem zu Anämie, Malabsorption und Gewichtsverlust führen. Zudem ist das Darmkrebsrisiko erhöht. Daher sollten Patienten mit gastrointestinalen Symptomen gründlich untersucht und adäquat behandelt werden.
Das sollten Sie lesen:
Der Autor empfiehlt folgende Referenzen als wissenschaftlich und/oder praktisch besonders relevant (im Text und in der Literaturliste markiert mit ••).
[7••] Torres J et al.: ECCO guidelines on therapeutics in Crohn’s disease: medical treatment. Stand 2020 Die aktuellen evidenzbasierten Empfehlungen der European Crohn’s and Colitis Organisation (ECCO) zur medikamentösen Behandlung des Morbus Crohn bieten eine praxisgerechte Anleitung zur Behandlung von Patienten mit Morbus Crohn.
[8••] Harbord M et al.: Third European evidence-based consensus on diagnosis and management of ulcerative colitis. Stand 2017 Der evidenzbasierte Konsensus der europäischen Fachgesellschaften gibt praxisgerechte Empfehlungen zur Behandlung
Literatur
[1] Adamina M et al.: ECCO guidelines on therapeutics in Crohn’s disease: surgical treatment. J Crohns Colitis 2020; 14: 155-68
[2] Rubin DT et al.: ACG clinical guideline: ulcerative colitis in adults. Am J Gastroenterol 2019; 114: 384-413
[3•] Maaser C et al.: ECCO-ESGAR guideline for diagnostic assessment in IBD part 1: initial diagnosis, monitoring of known IBD, detection of complications. J Crohns Colitis 2019; 13: 144-64
[4] Lichtenstein GR et al.: ACG clinical guideline: management of Crohn’s disease in adults. Am J Gastroenterol 2018; 113: 481-517
[5] Peyrin-Biroulet L et al.: Anti-TNF biosimilars in Crohn’s disease: a patient-centric interdisciplinary approach. Expert Rev Gastroenterol Hepatol 2019; 13: 731-8
[6•] Kucharzik T et al.: Aktualisierte S3- Leitlinie Colitis ulcerosa. Z Gastroenterol 2019; 57: 1321-405
[7••] Torres J et al.: ECCO guidelines on therapeutics in Crohn’s disease: medical treatment. J Crohns Colitis 2020; 14: 4-22
[8••] Harbord M et al.: Third European evidence-based consensus on diagnosis and management of ulcerative colitis. Part 2: current management. J Crohns Colitis 2017; 11: 769-84
[9] Burri E et al.: Position statement on the use of biosimilars in inflammatory bowel disease. Swiss Med Wkly 2019; 149: w20148
[10] Leitfaden der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ): Biosimilars. Stand: 08/2017 (www.akdae.de; Zugriff 7. 8. 2020)
[11] Dicheva-Radev S: Potenziale und Risiken von Biologika und Biosimilars: Empfehlungen der Arzneimittelkommission der deutschen Ärzteschaft zum Einsatz von Biosimilars. Bremen, 7. März 2020
[12] Markus R et al.: A review of the totality of evidence supporting the development of the first adalimumab biosimilar ABP 501. Adv Ther 2019; 36: 1833-50
[13] Swissmedic. Guidance Document Authorisation Biosimilar. 2018 [cited 2020 August 17]; available from: https://www. swissmedic.ch/dam/swissmedic/en/dokumente/zulassung/ zl/zl101_00_003d_wlverwaltungsverordnunganleitungzulassungaehnliche. pdf.download. pdf/ZL101_00_003e_WL%20Guidance%20document% 20Authorisation%20Biosimilar.pdf
[14] Danese S et al.: ECCO position statement on the use of biosimilars for inflammatory bowel disease-an update. J Crohns Colitis 2017; 11: 26-34
[15] Cohen HP et al.: Switching reference medicines to biosimilars: a systematic literature review of clinical outcomes. Drugs 2018; 78: 463-78
[16] Jørgensen KK et al.: Switching from originator infliximab to biosimilar CT-P13 compared with maintained treatment with originator infliximab (NOR-SWITCH): a 52-week, randomised, double-blind, non-inferiority trial. Lancet 2017; 389: 2304-16
[17] Ribaldone DG et al.: Effectiveness and safety of adalimumab biosimilar ABP 501 in Crohn’s disease: an observational study. Rev Esp Enferm Dig 2020; 112: 195-200
[18] Pouillon L et al.: Consensus report: clinical recommendations for the prevention and management of the nocebo effect in biosimilar-treated IBD patients. Aliment Pharmacol Ther 2019; 49: 1181-7
[19] Odinet JS et al.: The biosimilar nocebo effect? A systematic review of double-blinded versus open-label studies. Manag Care Spec Pharm 2018; 24: 952-9
[20] Schneider R et al.: Helsana-Arzneimittel-Report. Auswertungsergebnisse der Helsana Arzneimitteldaten aus den Jahren 2015 bis 2018. 2019 https:// www.helsana.ch/dam/de/pdf/helsana-gruppe/ publikationen/arzneimittelreport-2019.pdf
[21] Bundesamt für Gesundheit: Handbuch betreffend die Spezialitätenliste (SL). 2017 https://www.bag.admin. ch/dam/bag/de/dokumente/kuv-leistungen/bezeichnung- der-leistungen/antragsprozesse-arzneimittel/ handbuch-betreffend-die-spezialitaetenliste- gueltig-ab-01.05.2017.pdf.download.pdf/ Handbuch%20betreffend%20die%20 Spezialit%C3%A4tenliste%20G%C3%BCltig%20ab%2001.05.2017.pdf
[22] Peyrin-Biroulet L et al.: Anti-TNF biosimilars in Crohn’s disease: a patientcentric interdisciplinary approach. Expert Rev Gastroenterol Hepatol 2019; 13: 731-8
[23] Rich G et al.: A randomized placebo-controlled trial on the effects of menthacarin, a proprietary peppermint- and caraway-oil-preparation, on symptoms and quality of life in patients with functional dyspepsia. Neurogastroenterol Motil 2017; 29: doi: 10.1111/nmo.13132
[24] Madisch A et al.: The diagnosis and treatment of functional dyspepsia. Dtsch Arztebl Int 2018; 115: 222-32
[25] Andresen V et al.: Reizdarmsyndrom – eine Krankheit. Dt Med Wochenschr 2018; 143: 411-9
[26] Layer P et al.: S3-Leitlinie Reizdarmsyndrom: Definition, Pathophysiologie, Diagnostik und Therapie. Gemeinsame Leitlinie der Deutschen Gesellschaft für Verdauungs- und Stoffwechselkrankheiten (DGVS) und der Deutschen Gesellschaft für Neurogastroenterologie und Motilität (DGNM). Z Gastroenterol 2011; 49:237-93
[27] Drossman DA: Functional gastrointestinal disorders: history, pathophysiology, clinical features and Rome IV. Gastroenterology 2016; 150: 1262-79
[28] Blackshaw LA et al.: TRP channels: new targets for visceral pain. Gut 2010; 59: 126-35
[29] Koch E et al.: Beitrag schaumhemmender Effekte von Pfefferminz- und Kümmelöl zu den karminativen Wirkungen von Menthacarin. Z Phytother 2015; 36: S34-5
[30] Hawrelak JA et al.: Essential oils in the treatment of intestinal dysbiosis: a preliminary in vitro study. Altern Med Rev 2009; 14: 380-4
[31] Madisch A et al.: Treatment of functional dyspepsia with a fixed peppermint oil and caraway oil combination preparation as compared to cisapride. A multicenter, reference- controlled double-blind equivalence study. Arzneimittelforschung 1999; 49: 925-32